神經細胞的能量耗盡怎麼辦?
當我們在努力思考的時候,大腦的神經細胞會消耗很多能量,如果能量的代謝失去平衡,我們是否還能維持原有的認知能力呢?21 世紀初,研究發現阿茲海默症患者腦內腺苷出現失衡狀態,而腺苷正是細胞能量單位 ATP 的材料,腺苷的調控與神經退化兩者之間有關係嗎?如何讓神經細胞再次「充飽電」?中央研究院「研之有物」專訪院內生物醫學科學研究所所長陳儀莊特聘研究員與其團隊,他們已投入腺苷研究多年,從腺苷調控的基礎研究,到阿茲海默症的新藥開發,關鍵的「腺」索,或許就藏在這個不起眼的小分子之中。
在最近的臺灣影集《忘了我記得》劇情中,我們可以看到女主角程樂樂與父親之間的感人互動,以及她面對父親認知能力退化的無力感。失智症(dementia)是臺灣邁入超高齡社會之後,需要認真思考和對待的議題。
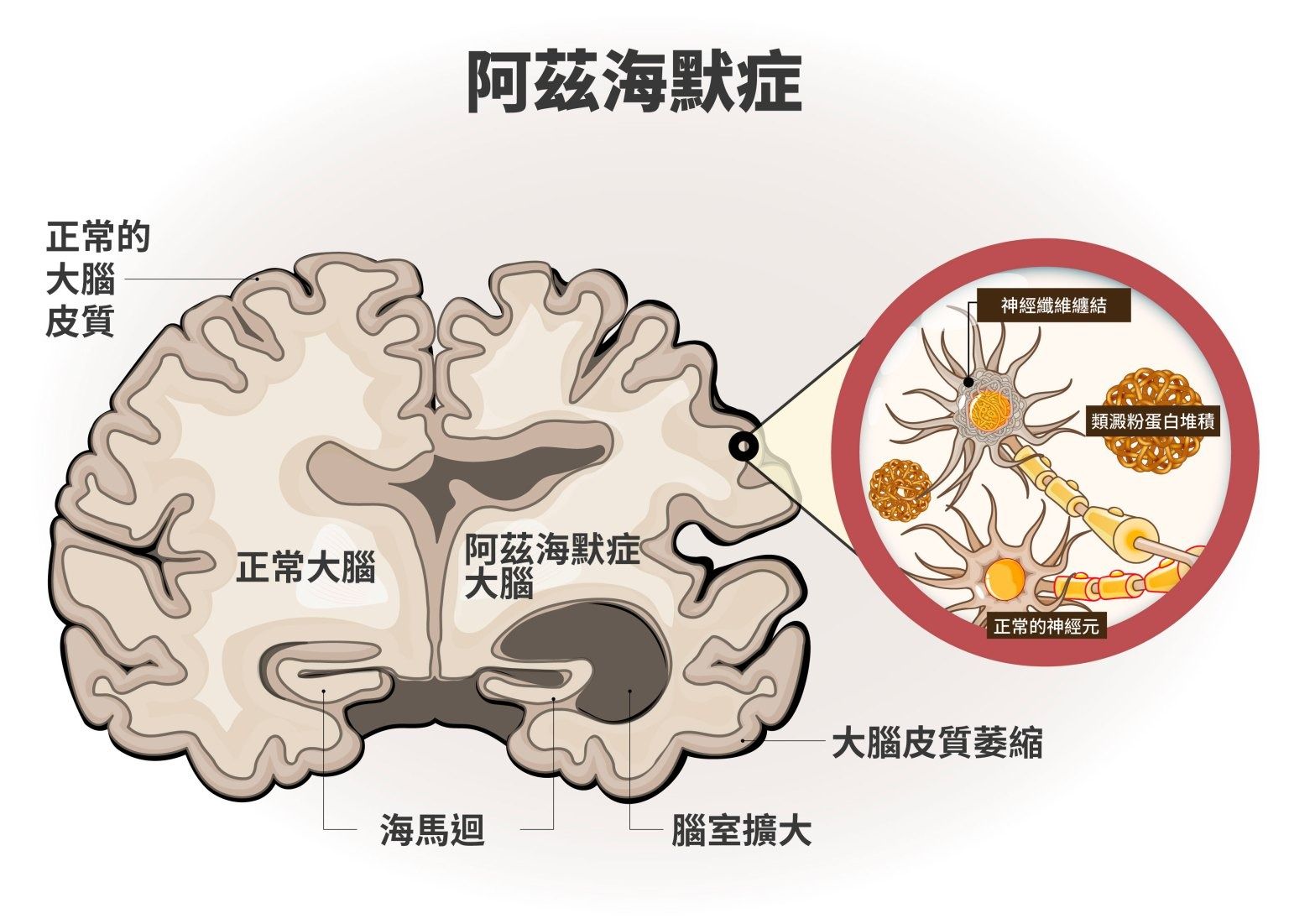
根據世界衛生組織(WHO)統計,2021 年全球約有 5,700 萬名失智症患者,每年新增病例近 1,000 萬人,預估到 2050 年將突破 1.5 億人。失智症並非單一疾病,而是指一群會影響記憶、認知與日常功能的症候群,其中最常見的類型便是阿茲海默症(Alzheimer’s disease),約占所有失智症的 60% 至 70%。
在臺灣,失智症的盛行率亦隨著高齡人口增加而節節上升。根據 2024 年衛生福利部公布的「全國社區失智症流行病學調查」結果,全臺 65 歲以上長者失智症盛行率為 7.99%,推估約有 35 萬人罹患失智症,其中,阿茲海默型失智症占比最高,約五成六。此外,失智症的盛行率隨年齡增加而上升,90 歲以上族群的盛行率高達 36.88%。
隨著 2025 年臺灣步入超高齡社會,失智症的負擔將日益沈重,開發有效的治療方法成為當務之急。在這樣的科學與社會交會點上,中央研究院生物醫學科學研究所的陳儀莊與其團隊,選擇了一條鮮有人走的路:以「腺苷」為切入點,發展具創新機轉的新藥 J4,並完成第一位人類受試者的投藥,為阿茲海默症治療開啟新的可能。
為什麼選擇研究「腺苷」?
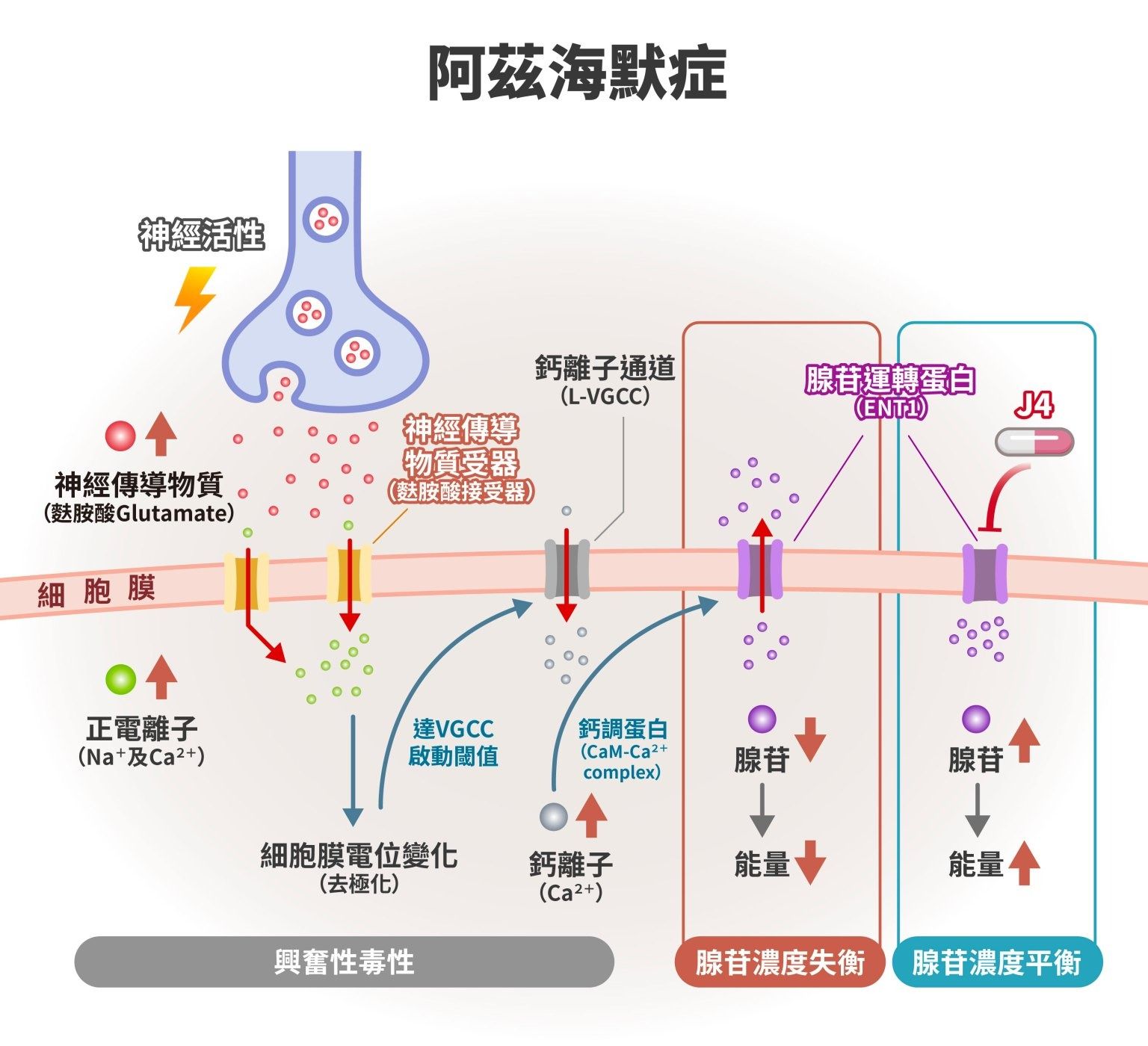
當我們一夜好眠,醒來吃了一頓營養美味的早餐之後,會覺得「能量」滿滿、精神充沛,對於即將開始的一天充滿信心與期待。But!如果是連續上了五天班之後,又又又遇到補班的星期六,大概很多人都會覺得「能量」耗盡,提不起精神工作。細胞也跟人一樣,需要能量來維持運作。對於細胞的能量來源 ATP 而言,腺苷(adenosine)扮演了極其關鍵的角色(註1)。
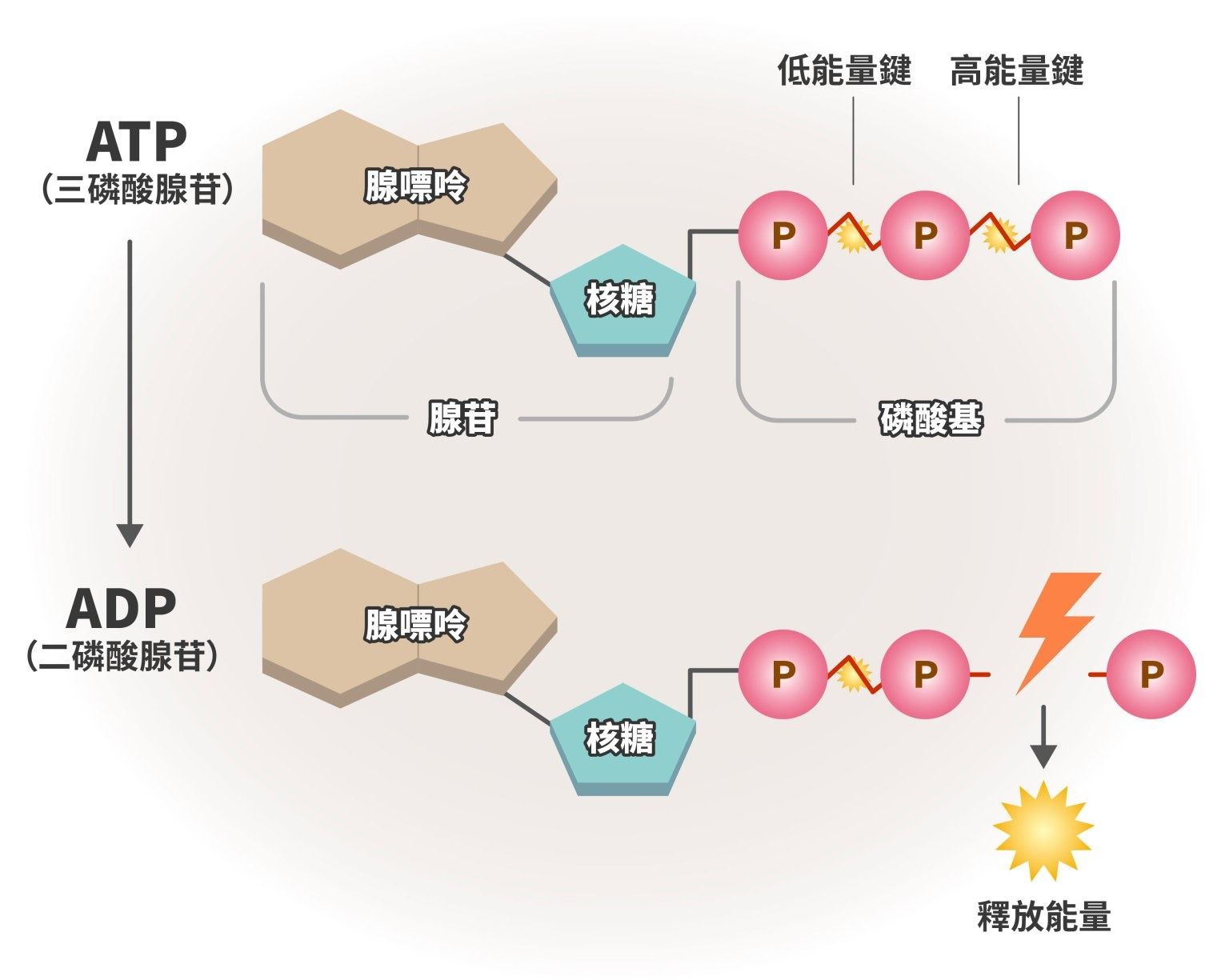
腺苷是由兩個化學零件組成的核苷分子:一個是腺嘌呤(含氮的鹼基),另一個是核糖(五碳糖)。它是細胞產生能量所需的重要材料,特別是在構成 ATP(三磷酸腺苷)時扮演關鍵角色。ATP 是細胞的「能量貨幣」,當細胞需要能量時,ATP 會釋放出其中一個磷酸基,提供能量讓細胞正常運作。
腺苷在高耗能的細胞中含量特別高,例如大腦的神經元和膠質細胞,這些細胞高度活躍時,會大量消耗 ATP。ATP 在提供能量的過程中,會依序分解成 ADP(雙磷酸腺苷)、AMP(單磷酸腺苷),最終形成腺苷。細胞也會將這些分解產物重新合成 ATP,以維持穩定的能量供應。如此的能量循環調節,有助於神經系統維持正常。
陳儀莊自研究生涯早期便鎖定腺苷做為研究主題,主要是因為當時人們雖然已經知道腺苷的重要性,但對腺苷調控的了解仍十分有限。
腺苷除了作為組成 ATP 的重要材料外,也參與很多核心的生理功能,除了睡眠與記憶,還參與神經元的連結,以及調節神經的發炎反應。
這些生理功能是透過不同的受體去控制,一共有四種受體:A1、A2A、A2B 與 A3 受體,都屬於「G 蛋白偶聯受體」家族。腺苷會和這四種受體分別結合,調控神經元的活動。
此外,ENT1(Equilibrative Nucleoside Transporter 1)是一種存在於細胞膜上的通道蛋白(核苷轉運蛋白),負責腺苷的雙向運輸,協助調節細胞內外腺苷濃度。
當 ENT1 功能異常時,腺苷濃度失去平衡,細胞內腺苷可能大量流失,影響細胞能量代謝與生理平衡。 陳儀莊團隊長期投入腺苷研究,促進學界對於腺苷、腺苷受體和轉運蛋白的了解,也為團隊後續的新藥設計打下堅實基礎。
神經元的「腺」索?腺苷與阿茲海默症的關係
在阿茲海默症研究領域,過去數十年來,β 類澱粉蛋白(amyloid β, Aβ)的堆積一直被視為致病主因,許多藥物設計也集中於清除 β 類澱粉蛋白。
然而,目前市面上的抗體藥物雖可有效降低 Aβ,但只能部分延緩疾病的發展,而且還有一定程度的副作用。因此,許多國際研究團隊逐漸將焦點轉向其他病理機轉,包括 tau 蛋白的過度磷酸化、神經發炎反應等。
這是因為阿茲海默症的病理過程十分緩慢,可能長達十年或更久。患者可能在認知能力退化之前的十多年,大腦內便已開始有 β 類澱粉蛋白過度堆積的現象。也就是說,β 類澱粉蛋白的治療可以幫助延緩疾病,但如果要改善已經因為神經細胞退化產生的認知衰退,療效可能較為有限。
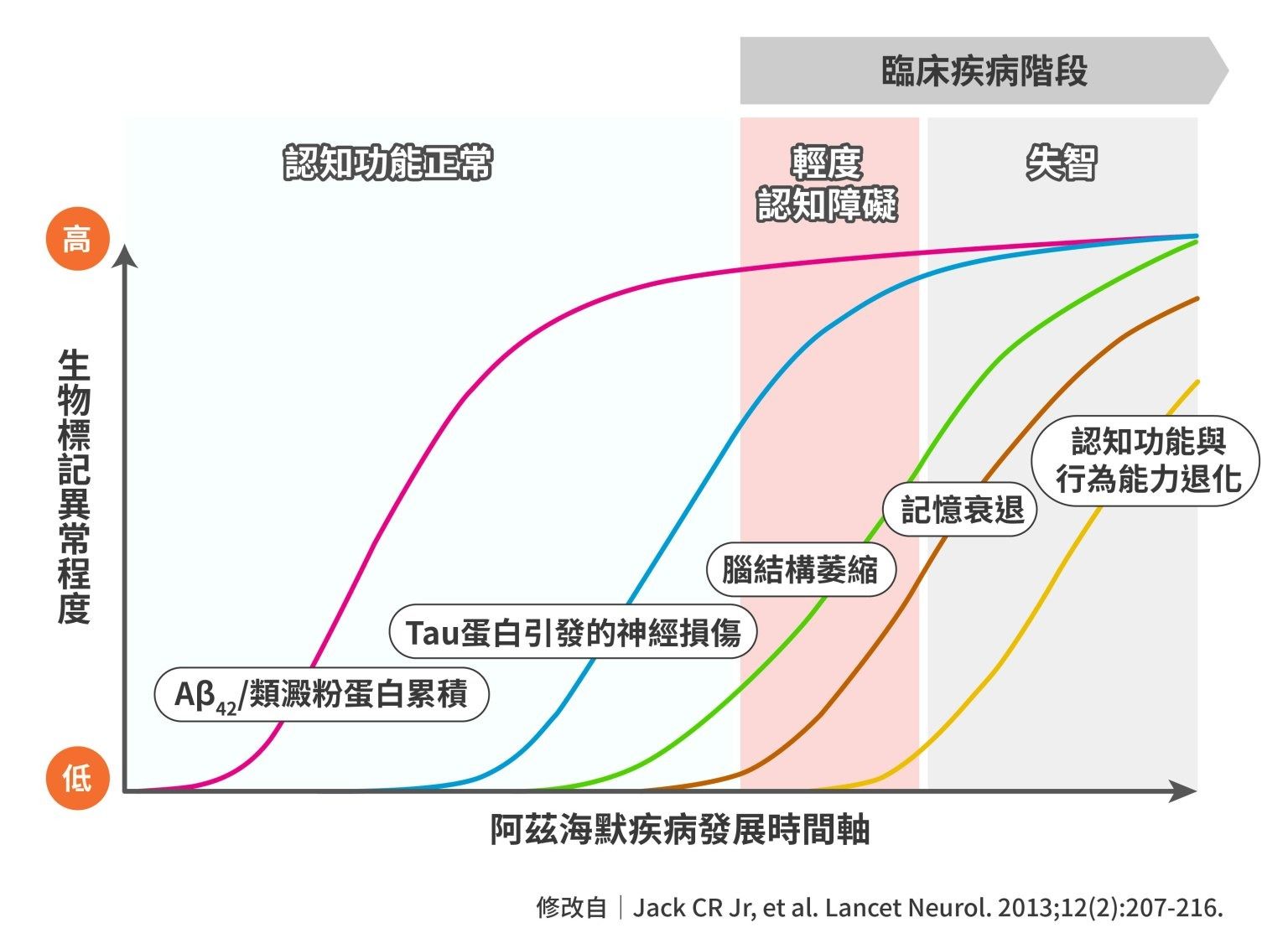
陳儀莊表示,β 類澱粉蛋白的堆積會引發一連串的病理變化,包含 tau 蛋白的過度磷酸化、神經發炎,最終導致記憶力衰退等明顯症狀。這個過程可以比喻成房子內部的一場火災:
"一開始只是廚房裡的小火悶燒,但若未及時處理,火勢會逐漸蔓延至客廳、臥室等區域,等到整棟房屋都瀰漫煙霧時,才會察覺問題已經變得嚴重。"
此時,如果只針對廚房初期的起火點進行處理,而忽略了其他區域的火勢,就難以有效控制整場火災。同樣地,除了設法清除 β 類澱粉蛋白,也需要關注神經發炎等後續變化,才能全面應對疾病的進展。
那麼,腺苷在阿茲海默症的病理機制中所扮演的角色是什麼呢?
儘管早在 20 世紀,科學家便已發現腺苷可以調節神經傳導物質,但直到近期,人們才發現它是阿茲海默症病理的關鍵一員。21 世紀初,研究發現阿茲海默症患者腦內腺苷出現失衡狀態,也發現過度活化的 A2A 受體在阿茲海默症模型中(註2),可能會促進 tau 蛋白磷酸化,引發學界開始好奇:腺苷訊號與神經退化兩者之間的關連。
研究發現,當通道蛋白 ENT1 活性出現異常時(註3),如果太多腺苷被排出到細胞外、將可能導致細胞內腺苷濃度降低,進而使神經細胞內 ATP 變少,細胞代謝失去平衡。
J4 的誕生:從基礎研究到候選藥物
在證實腺苷與阿茲海默症病理之間的關係之後,陳儀莊團隊開始思考如何將基礎研究應用在臨床治療上。J4 的故事,正式開始。
團隊與衛生福利部國家中醫藥研究所的林雲蓮研究員展開合作。林雲蓮研究中藥植物多年,發現中藥材天麻中含有可保護神經細胞的活性成分。因此,陳儀莊團隊協同臺灣大學化學系方俊民教授,以天麻為起點,展開化學最佳化與結構改造,最終開發出 J4——具有高度選擇性的第三代 ENT1 抑制劑。
為了驗證 J4 能否有效調整細胞內外腺苷失衡的狀況,並改善阿茲海默症狀,陳儀莊團隊使用了兩種阿茲海默症小鼠模型進行了實驗,分別是 APP/PS1 小鼠以及 Tau22 小鼠。APP/PS1 小鼠是模擬阿茲海默症的 β 類澱粉蛋白沈積這項病理特徵,Tau22 小鼠則模擬 tau 蛋白過度磷酸化這項病理特徵。
陳儀莊團隊在動物上的療效研究顯示:兩種小鼠模型服用 J4 後,表現出優越的治療效果,包括改善認知功能障礙和受損的空間記憶能力,減少異常堆積的澱粉樣斑塊和神經纖維糾結堆積,同時提高小鼠腦部的粒線體和葡萄糖代謝活性,並減輕大腦氧化壓力和神經發炎。
上述小鼠實驗結果不只支持腺苷失衡在阿茲海默症病理中的關鍵角色,也證實了 J4 作為治療阿茲海默症藥物的潛力。
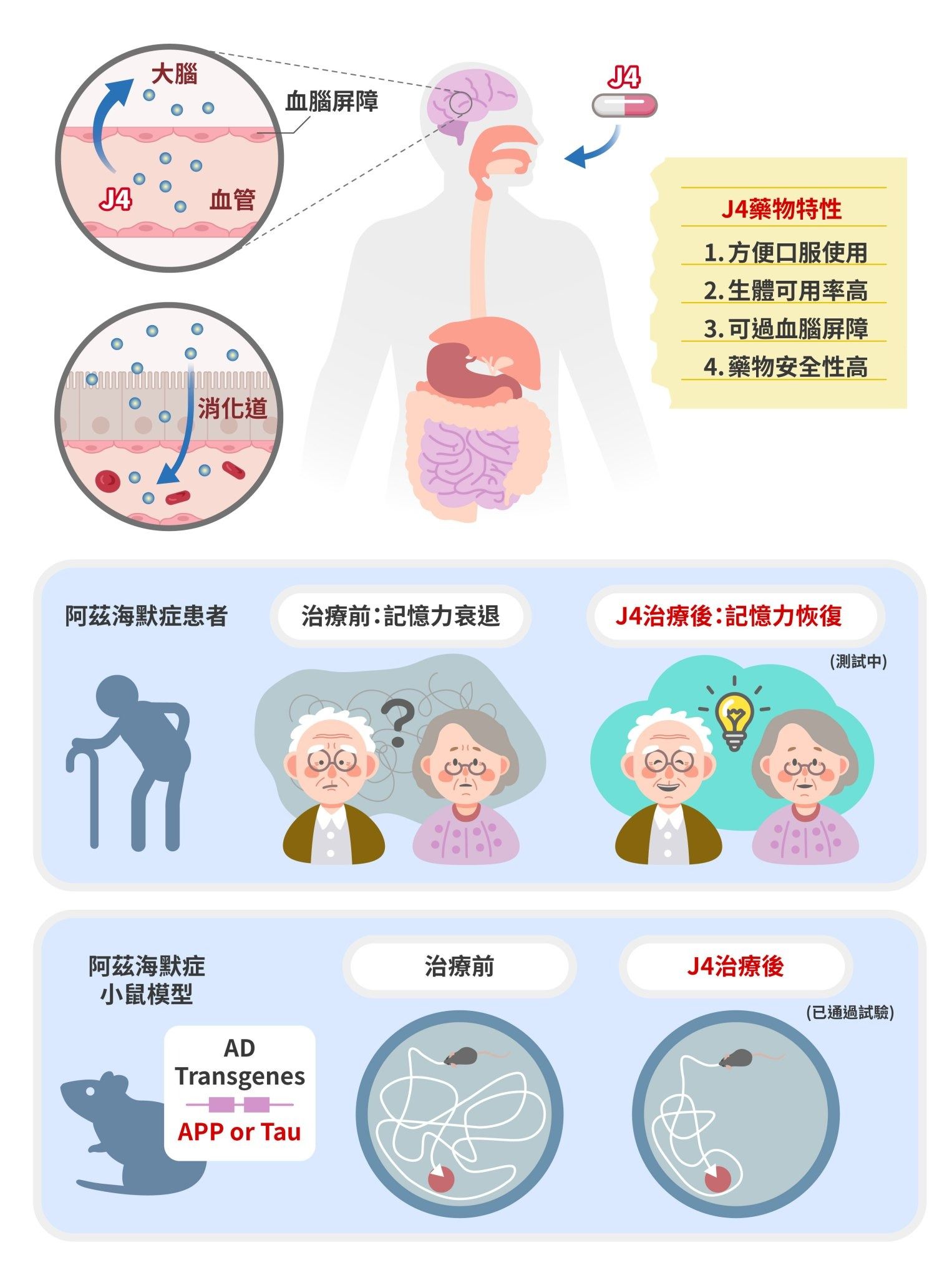
關於 J4 藥物的研發過程,絕對不是輕鬆愉快的。從出發點天麻萃取物到 J4 之間,經過研究團隊的化學家、藥物動力學家與分子模擬學家等各種專業努力合作,才終於開發出來。團隊成員林建宇博士特別指出,J4 之所以優於第一、第二代合成物,一項關鍵是 J4 在動物模型身上的「生體可用率」(bioavailability)達到了 65%。
"生體可用率,是指藥物經口服後,有多少比例能順利進入血液循環中。這個比例越高,代表藥物更容易被身體吸收與利用。"
如果某個藥物在經過消化系統後只剩下非常低的濃度進入血液,例如 3%,那麼之後可以成功穿過血腦屏障進到大腦內的濃度肯定少之又少,也很難達到任何治療效果。足夠高的生體可用率,為 J4 這種小分子化合物進入人體試驗奠定了一定的基礎。
林建宇博士也提到,在開發研究題目時,如何挖掘出國際上「未被滿足的醫療需求」非常重要。像失智症等神經退化性疾病,目前都沒有很好的治療方案,如果有機會發展藥物解決這個需求,未來可以省下很多社會成本。

從實驗室到臨床:J4 藥物的轉譯挑戰
談到為何選擇從實驗室走向臨床開發,陳儀莊及團隊成員張敬邦博士等人都表示:希望自己的研究能夠使用在臨床治療,對病人有更直接的幫助,而非僅僅停留在實驗室環境內。
新藥 J4 要從實驗室走向病人,轉譯過程極為嚴格繁複,而團隊的多元專業背景也幫助 J4 一路上克服各種挑戰。除了張敬邦博士、林建宇博士和吳國禎博士等人在神經科學、藥物動力學與動物實驗有深厚的專業背景,還有藥學背景的吳靖雯專案經理,負責臺灣與美國的新藥臨床試驗(Investigational New Drug, IND)申請,也負責臨床試驗的監督。
"臨床試驗是很高的技術門檻,在申請時需要準備藥物結構、藥理作用、毒性研究、製劑、安全性評估等資料,必須先證明安全性,才能讓藥物進入人體臨床試驗階段。"
2024 年,J4 正式通過臺灣與美國的新藥臨床試驗申請,並於 2025 年進入人體臨床試驗,目前已完成了全球第一位人類受試者的投藥,正在進行臨床一期實驗。J4 的發展歷程從最初的基礎研究發現,到目前進入臨床試驗階段,全程皆於臺灣進行,可以說,J4 在臺灣阿茲海默症藥物研發史上已創下了里程碑。
然而,陳儀莊團隊對此仍保持科學家的謹慎態度。她表示,雖然 J4 已在臨床前的動物試驗中展現出良好的安全性與療效,但對於人體的實際效果仍是未知數,在臨床試驗結果出爐之前,應避免過度樂觀的期待。
從基礎研究到製藥,團隊也深切體會到溝通的挑戰——科學家要如何與其他領域專業人士溝通?經歷新聞媒體、藥廠,或商業背景人士,團隊成員們或多或少經歷過溝通困難的挫敗與無力,或許是因為習慣使用過多專業術語,容易讓外界聽不懂。
新藥的競爭力來自基礎研究的創新
J4 的研發不是個人的壯舉,而是團隊多年累積與協作的成果。在這條艱難的轉譯路徑上,陳儀莊始終贊同美國國家科學院院士 Harvey Lodish 所言:「新藥的競爭力來自於其基礎研究的新穎性」。
藥物開發過程並不短暫,也不保證成功。然而從國際經驗中可看到,只要選題正確、策略明確,並有持續投入與專業分工的團隊支持。即便是起於學術端的發現,也有機會在臨床與產業領域發光。
「GLP-1 受體促效劑」(或稱為瘦瘦針)便是典型案例,從 1980 年代的基礎研究逐步轉化為治療糖尿病與肥胖的全球矚目新藥,《Nature》和《Science》期刊於 2023 年一致將 GLP-1 藥物列入年度重大科學回顧,其帶動的不只是醫療進展,也成為推動丹麥生技產業的關鍵引擎,更為國家經濟貢獻良多。
未來 J4 是否能順利上市,成為治療失智症的一線藥物,仍將面臨許多考驗與挑戰。陳儀莊團隊表示將會竭盡全力、積極推動。團隊強調,在研發過程中所累積的技術能力與人才資本,也將會是無價的科研資產。
陳儀莊團隊將持續深耕腺苷相關研究,期望以此為基礎,開拓更多神經退化性疾病的治療策略,讓這條「腺」索延伸出更多未來的可能性。
註1:腺苷是一種能調節神經與能量平衡的核苷分子,透過細胞膜上的受體與轉運蛋白共同維持體內平衡。
註2:A2A 受體是大腦中主要的腺苷受體之一,主要表現在神經元與星狀膠細胞,具有促進神經傳導與活化 cAMP 訊號的功能。A2A 受體的活性與腺苷濃度高度相關,因此腺苷濃度的變化會直接影響其訊號強度。
註3:ENT1 是一種存在於細胞膜上的被動核苷轉運蛋白,負責腺苷的雙向跨膜運輸。當細胞內腺苷濃度升高時,ENT1 會促進腺苷外流,提升細胞外腺苷濃度,進一步活化 A2A 受體,產生下游訊號。











