打開新冠病毒的潘朵拉盒子
科學家揭露新冠病毒基因組和棘蛋白胺基酸序列,探索其感染機制。
撰文/王雯靜、蘇士哲
2020-05
去年11月17日,中國湖北省武漢市一張胸部電腦斷層掃描(CT)影像出現毛玻璃狀結節(nodule),疑似新型肺炎病例,病因成謎。隨著年關將近,人們在12月開始頻繁奔波各地,武漢市位居中國交通樞紐,陸續發現數起新型肺炎的病例。疫情似乎悄悄蔓延。
12月30日武漢中心醫院醫師李文亮透過網路社群通知同事,華南海鮮市場出現類似嚴重急性呼吸道症候群(SARS)的病患,應小心防護。不幸的是,李文亮因這種新型肺炎於今年2月7日病逝於武漢金銀潭醫院。英國醫學期刊《刺絡針》(Lancet)特別於2月18日發文悼念李文亮,引述了美國約翰霍普金斯大學彭博公衛學院主任英格勒斯比(Tom Inglesby)的一句話:「世界上最重要的預警系統是,醫護人員意識到某種新疾病正在出現,然後發出警報。」
醫學界現在清楚知道這種新疾病是由人傳人的新冠病毒(SARS-CoV-2)所引起,命名為嚴重特殊傳染性肺炎。但人們太晚意識到「吹哨人」發出的警報,低估新冠病毒的傳染力,疫情迅速從中國傳到新加坡、韓國、日本等亞洲區域,蔓延到歐洲地區(特別是義大利以及西班牙),再擴散至美洲地區(美國紐約成為重災區),死亡和感染病例以指數型曲線與日俱增。今年4月下旬,全世界的確診病患有200多萬人,死亡人數超過17萬人。人類正面臨21世紀的瘟疫。
但事情可能有轉機。去年12月24日,上海復旦大學公共衛生臨床中心的張永振和澳洲雪梨大學的霍姆斯(Edward C. Holmes)取得武漢中心醫院一名肺炎患者的檢體,並於今年1月5日從樣本中鑑定出新冠病毒,透過次世代定序獲得全基因組,當天立即上傳至「全球共享禽流感數據倡議組織」(GISAID)及美國國家生物科技資訊中心基因資料庫(NCBI/GenBank),是新冠病毒第一筆公開全基因組序列。
緊接著,中國科學院武漢病毒研究所研究員石正麗團隊從五位新冠肺炎患者採樣的檢體中鑑定出五筆新冠病毒的基因組序列,在1月底發表於《自然》期刊。幾乎在同一時間,中國疾病預防控制中心武桂珍等研究人員從九位新冠肺炎患者的檢體中鑑定出10筆新冠病毒的基因組序列,發表於《刺絡針》。截至3月底,有3000多筆新冠病毒的基因組序列上傳至GISAID,研究人員分析了這些資料,發現新冠病毒自去年底在中國武漢首次出現,短時間內傳播的病毒可追溯至同一感染源,然而隨著陸海空交通、人傳人的移動感染,新冠病毒的基因組正持續變異。
會感染人類的冠狀病毒包括:引起輕微症狀的人類冠狀病毒OC43、HKU1、NL63、229E,以及引起嚴重症狀的中東呼吸症候群冠狀病毒(MERS-CoV)、嚴重急性呼吸道症候群冠狀病毒(SARS-CoV)、新冠病毒。從基因組分析可發現,新冠病毒與SARS病毒基因相同度約有80%,複製酶的胺基酸序列相同度達到94%,表明這兩種病毒屬於同一類;而新冠病毒與中國雲南當地的中華菊頭蝠(Rhinolophus affinis)冠狀病毒RaTG13整體基因相同度更達到96%,代表演化關係更接近。但如果比較與感染細胞直接相關的棘蛋白(spike protein)基因組,新冠病毒與RaTG13的相同度高達93%,與SARS病毒的相同度卻只有75%左右,因此科學家已排除新冠病毒與SARS病毒的同源關係。而這些差異正是新冠病毒引起全球大爆發的關鍵。
鑰匙與鎖孔
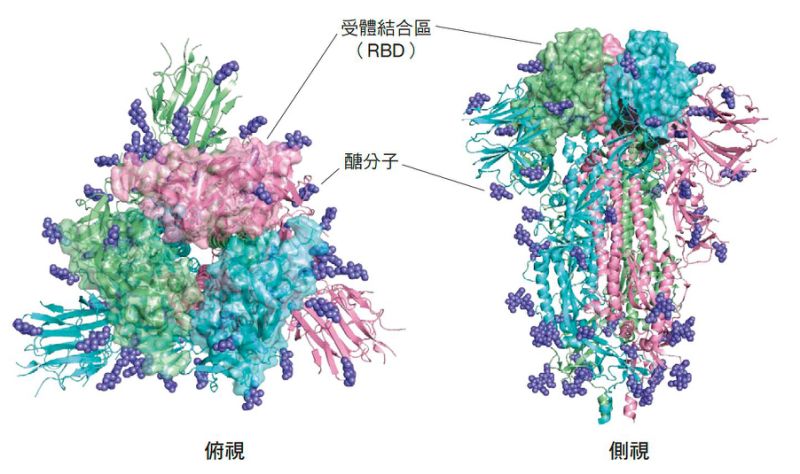
冠狀病毒因其表面的棘蛋白在電子顯微鏡下看起來像是皇冠周圍的凸起裝飾而得名。棘蛋白在冠狀病毒上扮演感染細胞的關鍵角色,目前已證實新冠病毒感染人體是透過棘蛋白結合到人體細胞表面的第二型血管收縮素轉化酶(ACE-2)受體;接著棘蛋白被細胞內的蛋白酶剪切,暴露出融合勝肽序列進而與細胞膜融合,順利進入細胞(參見下方〈新冠病毒的超級鑰匙〉)。如果想了解新冠病毒為何有如此強的感染力,就必須先分析棘蛋白及ACE-2受體的胺基酸序列。
仔細比較新冠病毒與SARS病毒的棘蛋白胺基酸序列,可發現幾處明顯的差異。首先是棘蛋白的受體結合區(RBD),以冷凍電子顯微鏡技術可以看出新冠病毒的棘蛋白會與ACE-2緊密地結合,形成棘蛋白-ACE-2複合體。兩種病毒結合到ACE-2的RBD,至少有六個關鍵胺基酸相異,新冠病毒與人類ACE-2受體的結合常數因著這項差異提高20倍,比起SARS病毒具較高的感染力。
相較其他冠狀病毒,新冠病毒棘蛋白另一個特別之處在於蛋白質中間多了一小段多鹼性勝肽序列PRRA,(參見27頁〈胺基酸序列比較〉)。科學家推測PRRA序列讓人類細胞內的蛋白酶 Furin可以更快速且有效率地剪切棘蛋白,活化與細胞膜融合的步驟以感染細胞。這段特殊的多鹼性勝肽也可能是造成新冠病毒全球大流行的關鍵,但還需要更多實驗證明其功能。
PRRA序列成為科學家尋找新冠病毒演化足跡的重要片段,目前所有已知的野生株冠狀病毒都沒有這段序列,宛如天外飛來一筆地加入新冠病毒的棘蛋白基因,使得科學家追溯新冠病毒的起源變得十分棘手。如果能夠找到其他帶有該片段(或是部份片段)的冠狀病毒及其宿主,就有可能推斷出新冠病毒演化的真正源頭……
抽絲剝繭找中間宿主
在新冠病毒演化上應該還有未知的角色參與其中,人類和蝙蝠之間的中間宿主有四項特性:首先,病毒對中間宿主不能有太強的致死性,才能不斷讓中間宿主帶原;其次,中間宿主的數量要足夠,並藉由群聚生活交互傳染,累積較多的病毒突變;第三,中間宿主必須有機會接觸人類;最後,中間宿主應該帶有與人類相近的ACE-2基因序列。
新冠病毒的棘蛋白除了與人類ACE-2有高度專一的結合性,在動物實驗中,也可以感染帶有蝙蝠、果子狸、鳥類等不同生物中具有ACE-2受體的細胞。科學家比較ACE-2受體的胺基酸序列之後發現,蝙蝠、果子狸、鳥類,甚至蛇的ACE-2受體,都與人類ACE-2受體相當類似,這暗示人類新冠病毒一開始有可能潛伏在這些生物中。然而,目前並沒有直接證據顯示,華南海鮮市場存在可能的中間宿主,而成為疫情的起源地;也沒有發現任何單一來源的動物帶有具關鍵突變的病原體,再經由基因重組產生新冠病毒。
不過,野生動物及人類高密度聚集的交易場所是否有可能提供了大自然從未出現過的場景,因而發生不可思議的跨物種(包含人類)交叉感染,成為基因重組、累積突變的溫床?科學家藉由更全面的基因序列比對,在廣東野生動物救護中心收集到的穿山甲樣本上頭找到一株冠狀病毒(PRJNA573298),整體上與新冠病毒基因組序列相同度雖然不如RaTG13,但棘蛋白的RBD與新冠病毒幾乎使用相同的胺基酸,因此有科學家提出穿山甲可能是蝙蝠及人類之間的中間宿主。當然,這樣的結果也可能來自人類與不同野生動物交叉傳染後,冠狀病毒基因不斷重組、累積突變成具有超強感染力的新冠病毒,再次回到人類跟人類間的傳染,最後爆發出疫情。但無論如何,從穿山甲身上找到的冠狀病毒序列,提供了自然界跨物種演化出新冠病毒的可能。
篩檢與治療的契機
新冠病毒特殊的棘蛋白可以做為臨床檢驗及治療標的,利用RNA依賴型RNA聚合酶(RdRP),做為反轉錄聚合酶連鎖反應(RT-PCR)的檢驗基礎,就可成為判斷感染的根據。受限於基本作用原理,RT-PCR需要多次反應來放大病毒基因序列,很難在一小時內完成篩檢,但是準確性高,適合在醫療單位做為最終的篩檢手段;機場通關或是有疑似病例出現時需要快速檢驗,則可以利用快篩晶片初步過濾。合成高專一性的抗體放置於快篩晶片的表面,就能偵測出是否有棘蛋白。如果專一性夠高,便可在數分鐘內區分新冠病毒與一般流感病毒。
過去醫療人員會從康復病人血清中取得可中和病毒的抗體,以達到治癒病人的效果。在細胞實驗上,也發現在SARS痊癒病人身上取得棘蛋白的抗體,能有效抑制新冠病毒棘蛋白的感染,未來如果能生產可中和棘蛋白的高專一性抗體,可望成為一種治療策略。而病毒棘蛋白結合到人體細胞膜後必須經剪切才能進一步感染細胞,因此針對相關的人體蛋白酶Furin設計藥物,用來抑制棘蛋白剪切、減緩感染力,將會是另一類相當有潛力的治療方式。
2003年,SARS來襲。相隔17年後,新冠病毒帶著超強的感染力襲捲而來,現代文明社會遭受前所未見的打擊,幾乎全面停擺。面對不斷演變的新冠病毒,科學家在基因組定序、結構生物學、公衛及流行病防治等領域有了長足的進步,在短短三個月內,我們已能一窺新冠病毒的面貌及作用機制,同時擬定治療策略。即使潘朵拉的盒子已經打開,這些無價的科學研究讓我們面對疫情時不會一籌莫展。在黎明來臨之際,世界必須團結一致,共同對付這個危險的敵人,相信不久之後,我們能戰勝這場嚴峻的瘟疫。











