等待肝源、接受移植,一直是終末期肝病的唯一有效手段。然而,肝源嚴重短缺卻成為一道擺在我們面前的難題,不少患者在苦苦等待肝源的過程中離開了人世,既然如此,人工造一個肝不行嗎?
當然行啦!由美國匹茲堡大學醫學院領銜的一組研究人員就利用人類皮膚細胞造出了迷你肝臟,移植到 5 隻大鼠體內後肝臟還正常運轉了 4 天。
2020 年 6 月 2 日,國際期刊 Cell Reports 刊登了該團隊題為《Assembly and Function of a Bioengineered Human Liver for Transplantation Generated Solely from Induced Pluripotent Stem Cells》(僅由誘導性多能幹細胞產生的用於移植的生物工程肝臟的組裝及其功能)的論文。
論文一開始,科學家們就給出下面這幅圖,我們終於能一圖讀懂科學領域重要突破了。
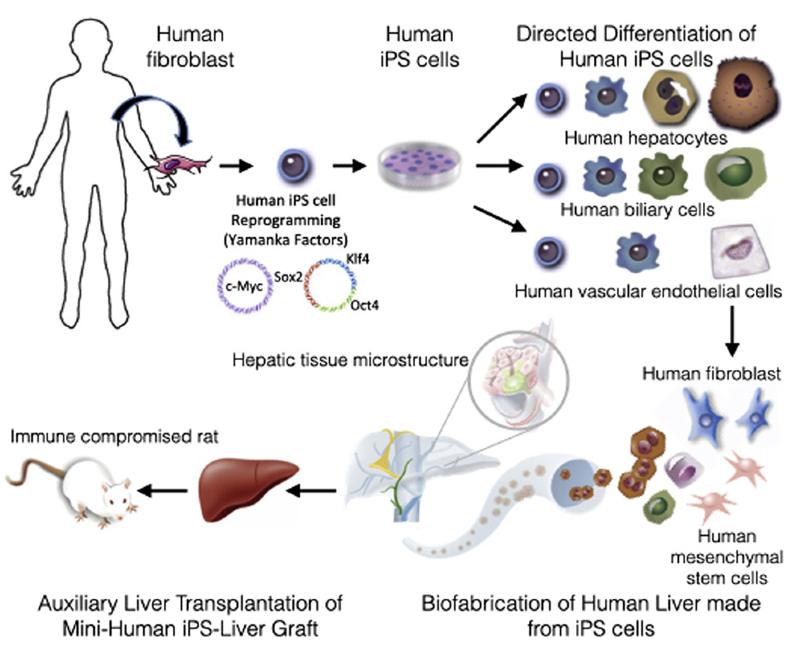
(Source:Cell Reports)
說起來,「造肝」的過程沒有想像中複雜:
1. 將人類皮膚細胞重編程為一種「誘導性多能幹細胞」。
2. 將「誘導性多能幹細胞」分化成多種肝細胞。
3. 將肝細胞接種到肝支架中培養,直至成熟。
看到這裡,不少人可能會問,「誘導性多能幹細胞」是什麼?
誘導性多能幹細胞是由誘導性多能幹細胞技術得來的。一般來講,科學家透過特定的轉錄因子,把成熟的體細胞透過重編程,就得到了多能幹細胞。這個過程沒有改變遺傳物質,而且「原材料」也並非胚胎細胞或卵細胞,因此這項技術不存在倫理方面的爭議。
這種技術還有一個好處──用患者自己的體細胞製備多能幹細胞,大大降低了免疫排斥反應出現的可能性。
誘導性多能幹細胞技術在醫學領域有著大用處,在細胞替代性治療、發病機理研究、新藥篩選等方面具有很大的潛力。
實際上,這個概念最早出現在 2006 年。當時,日本京都大學科學家 Shinya Yamanaka 將 4 個轉錄因子的組合轉入分化的體細胞中,透過重編程得到一種類似胚胎幹細胞和胚胎 APSC 多能細胞的細胞類型。
在這項實驗中,我們就可以簡單地把誘導性多能幹細胞理解為皮膚細胞和肝細胞兩者間的「中介」。
解決了「中介」的問題,可能又有人會問了,誘導性多能幹細胞分化成哪些肝細胞?
論文介紹,在低葡萄糖環境中,研究團隊引導誘導性多能幹細胞分化出了肝細胞、膽管細胞和內皮細胞。
而在分化過程中,科學家依據肝細胞生長因子、表皮生長因子、地塞米松、皮質醇、遊離脂肪酸、膽固醇、膽汁酸和利福平等物質的代謝與成熟訊息。值得一提的是,分化得到的肝細胞也是十分優秀──可以表達肝富集轉錄因子和肝臟特異性小分子 RNA,另外其線粒體水平和從人體內分離出的新鮮肝細胞無異。
那麼,如何把優秀的肝細胞培育成一顆肝臟,培育需要多久?
研究人員利用特別設計的灌注和器官培養室,首先重建膽管系統,接著重建薄壁組織內部空間,然後重建血管系統。研究人員將分化所得的細胞接種到肝支架中進行培養,不到一個月便造出了肝臟。
肝臟造好之後,進入到測試環節。研究人員選擇免疫受損的大鼠做為實驗對象,他們取出大鼠的肝臟,對其進行了輔助肝移植。
結果表明,人造肝臟能夠像正常肝臟一樣分泌膽汁酸和尿素,並在大鼠體內正常運轉了 4 天──在移植 4 天後,研究人員發現,肝臟內部及其周圍雖然出現了血流問題,但肝臟卻發揮著作用,大鼠血清中含有人肝蛋白。
對於未來的研究方向,論文合著者 Soto-Gutierrez 表示:
我們的長期目標是創造可替代肝移植的方案。比如,急性肝衰竭患者只需部分肝臟組織來維持機體正常運轉,在一定時間內增強肝功能,不需要等待肝源。
當然不可否認的是,這種方案仍然面臨不少挑戰,如何延長器官在體內的運轉時間、如何保證器官的安全性,都需要科學家們進一步的探索。











